La chromatographie ionique ou à échange d'ions
Elle consiste à un échange réversible d'ions entre la phase mobile et la phase stationnaire. Cette dernière est porteuse de groupements ionisés fixes et d'ions mobiles assurant l'électroneutralité. La résine doit être préparée suivant la séparation à effectuer et est régénérée en fin d'élution. Ce type de chromatographie permet donc de séparer des molécules selon leurs charges et s'adresse au produits ioniques ou ionisables. La séparation s'effectue donc selon la charge des analytes et leur rétention dans la colonne dépendra de leurs interactions avec les charges de la résine. Au niveau de l'instrumentation, elle se rapproche d'une HPLC classique. Le chromatogramme est également d'allure habituelle avec des pics dont le temps de rétention dépend de la nature des ions et de leur intéraction avec la phase stationnaire et la surface proprotionnelle à la concentration.
Pour les analyses de cations, les ions de l'éluant sont apportés par des acides minéraux ou organiques (oxalique, perchlorique, etc...) tandis que pour l'étude des anions on fera appel à des bases comme des carbonates, hydrogénocarbonates, soude, etc...
Les concentrations sont de l'odre de quelques mmol/L.
L'instrumentation de chromatographie ionique
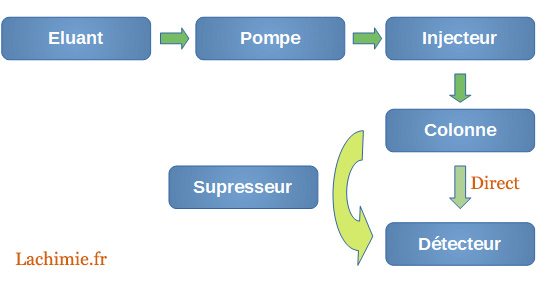
Comme pour l'HPLC, la chaîne est constituée :
- d'éluants
- d'un dégazeur
- d'une pompe
- d'un injecteur
- d'une colonne
- d'un suppresseur chimique
- d'un détecteur
L'éluant
Les éluants sont des solutions aqueuses qu'il faut préalablement traiter pour retirer le CO2.
En effet, celui-ci peut former des carbonates selon l'équilibre ci dessous :
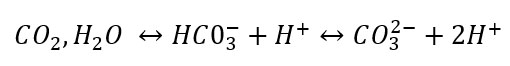 La formation de carbonates modifie la concentration initiale de ces ions et par conséquent engendre une modification des conditions de séparation.
Plusieurs solutions permettent de palier à ce problème :
La formation de carbonates modifie la concentration initiale de ces ions et par conséquent engendre une modification des conditions de séparation.
Plusieurs solutions permettent de palier à ce problème :
- Utilisation d'un absorbant à la chaux
- Réalisation d'un bullage à l'Hélium (plus coûteux)
Le suppresseur
Le suppresseur d'ions est indispensable dans l'analyse des anions. Il peut être chimique, à membrane ou électrolytique.
Le suppresseur est placé juste avant le détecteur et permet d'avoir un rapport signal/bruit beaucoup plus élevé en modifiant la nature des ions arrivant au détecteur.
Dans le cas des cations, le suppresseur n'est pas indispensable mais il permet toutefois de diminuer le bruit de l'analyse.
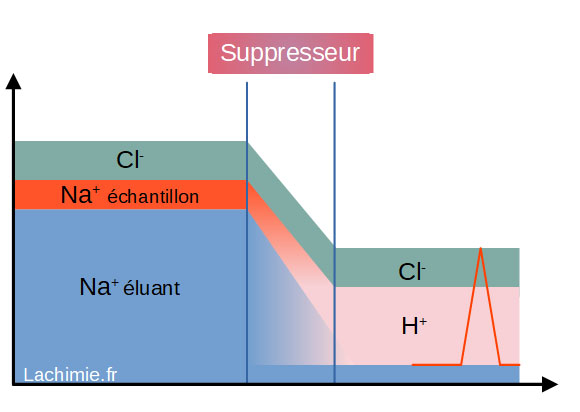
Exemple d'analyse d'anions
- Echantillon : solution de NaCl
- Phase mobile : solution de carbonate de sodium Na2CO3
- Supresseur électrolytique
- Détecteur : conductimètre
En présence d'un suppresseur électrolytique les ions Na+ vont être remplacés par des ions H+.
Ces derniers vont réagir avec les ions carbonates CO32- pour former de l'acide carbonique H2CO3 qui n'est pas conducteur. Le signal obtenu sera donc uniquement dû à la présence des chlorures Cl- et des protons issus de l'échange des ions sodium Na+ de l'échantillon. La conductivité molaire des protons étant très élevée, le signal est également amélioré.
La pompe et l'injecteur
La pompe est identique à celle d'une HPLC mais sa pression est limité pour protéger les colonnes plus fragiles que pour l'HPLC. La pompe et l'injecteur sont fabriqués dans des matériaux inertes (aucune partie métallique est en contact avec les solvants).
Le four et la colonne
Les mesures sont sensibles aux variations de température. La colonne est donc placée dans un four. La cellule du conductimètre peut également être mise dans l'enceinte thermostaté pour une meilleure stabilité des résulats.
Le détecteur
Le détecteur le plus fréquent est un conductimètre en ligne. La cellule est composée de 2 électrodes planes. La conductivité de la solution se situant entre ces deux plaques est mesurée. Les pics du chromatogramme correspondent à la variation de la conductivité lors du passage des ions.
Les détecteurs à ampérométrie sont également courants mais leur spécificité les rendent moins polyvalents. On peut rencontrer des détecteurs UV/visible ou électrochimiques. Des couplages masse ou ICP sont également possibles.
Quel est le principe de la chromatographie d'échange d'ions ?
Prenons par exemple le cas de la séparation d'anions X- d'une solution à analyser. Lorsque X- est en contact avec la phase stationnaire, il y a un échange entre X- et le contre-ion A- de la phase stationnaire. Il sera ensuite chassé à son tour par un contre-ion présent dans la phase mobile. Au final X- avance de sites en sites au cours de l'élution. Selon la nature des ions élués, leur progression est plus ou moins rapide, ce qui permet une séparation des différentes espèces ioniques dans un mélange.
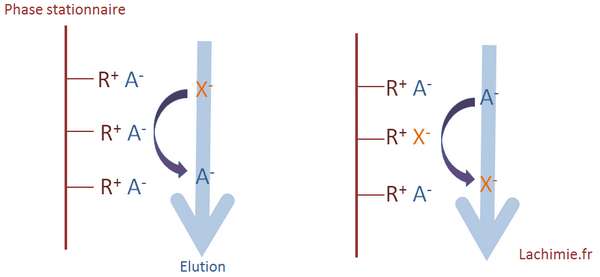
La vitesse d'élution est dépendante des échanges ioniques entre la phase stationnaire et la phase mobile. Pour l'étude des cations, la colonne doit être de type cationique et possède des sites capables d'échanger des cations. Pour les anions, c'est l'inverse avec une colonne pouvant échanger des anions.
Exemples de phases stationnaires
- fortement acide: -SO3-H+
- faiblement acide: -COO-H+
- fortement basique: -CH2-N+(CH3)3 Cl-
- faiblement basique -N+H(R2)Cl-
Comme pour l'HPLC, les fournisseurs proposent une large gamme de colonnes selon les analytes. Elles peuvent être des silices greffées ou des copolymères (Type Dowex®).