Analyse élémentaire d'un composé - correction de l'exercice
1) M = KC/ Δθ = 39*1/0,45 = 86,66 g/mol
Le composé contient comme élément C,H,O et N.
On peut donc écrire sa formule brute sous la forme : CxHyOzNw.
Les pourcentages en masse du carbone s’écrit :
%C = x.Mc/M avec Mc la masse molaire du carbone.
On en déduit : x = 0,551* 86,66/12 = 3,98
Il y a donc 4 atomes de carbones dans la molécule.
Avec le même résonnement pour les autres éléments on obtient :
y = 0,105*86,66/1 = 9,09 soit 9 atomes d’hydrogène
w = 0,159*86,66/14 = 0.98 soit 1 atome d’azote
Il ne reste plus qu’à déduire le nombre d’atomes d’oxygène :
z = (86,66 – 4*12-9*1-14*1)/16 = 15.66 soit 1 atome d’oxygène
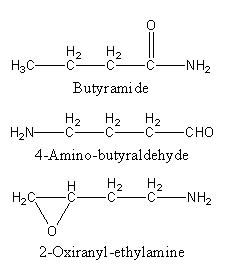
2)
Pour déterminer les formules brutes, il peut être utile de calculer le nombre d’insaturation :
ni = (2*4+2 +1 – 9)/2 = 1
il y a donc soit 1 insaturation soit 1 cycle
Rappel : la fonction amide s’écrit R-CO-NH2 (ici un amide primaire)
 Dans le cas d’une analyse en spectrométrie de masse à ionisation électronique, le pic moléculaire aura une masse impaire si la molécule contient 1 atome d’azote
Dans le cas d’une analyse en spectrométrie de masse à ionisation électronique, le pic moléculaire aura une masse impaire si la molécule contient 1 atome d’azote
Voir l'énoncé de l'analyse élémentaire