Dosage conductimétrique - Correction
1) schéma d'une cellule de conductivité
2) Ag+ + Cl- → AgCl (réaction considérée comme totale)
3) La conductivité de l’eau s’écrit σ= CH+λH+ + COH-λOH- avec CH+ et COH- la concentration des ions dans l’eau et λ les conductivités ioniques molaires.
D’après le produit ionique de l’eau [H+][OH-] = 10-14. On a pour de l’eau pure [H+]= [OH-]= 10-7
La conductivité vaut donc λ= 10-7x0,03498+10-7x0,01992 = 5,49.10-10 S/m
L’eau conduit très peu le courant électrique.
4)
![]() d’où σ = 5,49.10-10 + 0,1x0,00501+0,1x0,00763 = 1,26.10-3 S/m
d’où σ = 5,49.10-10 + 0,1x0,00501+0,1x0,00763 = 1,26.10-3 S/m
5) avant l’équivalence les ions en présence sont : Na+, H+, Cl-, NO3-, OH-
![]() 6) Après l’équivalence on a : Na+, Ag+, H+, NO3-, OH-
6) Après l’équivalence on a : Na+, Ag+, H+, NO3-, OH-
![]()
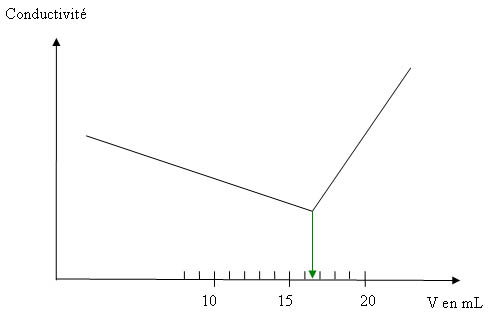
7) Tout au long du dosage les concentrations en H+, Na+ et OH- reste constantes. Avant l’équivalence, la variation de conductivité est donc due à la disparition des ions chlorures remplacés par des ions nitrates. Or ces derniers ont une conductivité ionique molaire inférieure aux chlorures. La conductivité diminue lentement jusqu’au point équivalent.
Après l’équivalence, on rajoute des ions Ag+ et NO3-. La conductivité remonte rapidement.
8) L’intersection des deux segments de droite donne un volume équivalent de 16,5mL.
A l’équivalence CCl-VCl-= CAg+VAg+ d’où CCl- = 1,65.10-2 mol/L
 9) On n’aurait pas obtenu des segments de droite suite à la dilution apportée par la solution de nitrate d’argent. Pour retrouver les droites, il aurait donc fallu corriger la valeur de la conductivité en fonction du volume versé.
9) On n’aurait pas obtenu des segments de droite suite à la dilution apportée par la solution de nitrate d’argent. Pour retrouver les droites, il aurait donc fallu corriger la valeur de la conductivité en fonction du volume versé.
Voir l'ennoncé sur le dosage par conductivité