Calcul de rendement
Le calcul du rendement permet de déterminer l'efficacité d'une synthèse chimique. L'intérêt du chimiste sera de déterminer des conditions opératoires permettant de l'optimiser pour s'approcher le plus près possible de 100%. Les pertes de rendement peuvent avoir diverses origines: réactions parasites, pertes lors des diverses étapes de la synthèse (filtration, séchage, recristallisation...)
Définition du rendement
Il est noté ρ et vaut:
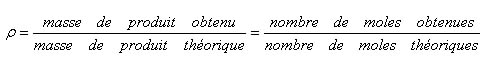
La masse de produit obtenu est la masse synthétisée. Elle est déterminée par pesée du produit obtenu.
La masse de produit théorique est la masse de produit correspondant à un rendement de 100%. Elle doit donc être calculée à partir de la masse des réactifs.
Calcul de rendement
Soit la réaction permettant la synthèse d'un produit C suivant
A + 2B ![]() C
C
La première étape consiste à calculer le nombre de moles des réactifs A et B afin de déterminer le réactif limitant. La méthode habituelle consiste à établir un tableau d'avancement.
Supposons que A soit le réactif limitant, la stoechiométrie de la réaction montre qu'une mole de A permet de synthétiser une mole de C. La masse de A permet donc de calculer le nombre de moles théoriques de C si la réaction est complète et d'en déduire le rendement.
Exemple concret de calcul
Synthèse du 1-bromobutane:
CH3-CH2-CH2-CH2-OH + HBr --> CH3-CH2-CH2-CH2-Br + H2O
Masse de 1- butanol pesée: 1,25 g
Masse de HBr pesée: 2 g
La masse de 1-bromobutane obtenue est de 1,6 g
Calculer le rendement de la réaction.
Etape 1: rechercher le réactif limitant
Nombre de moles de 1-butanol: n= 1,25/74,12 = 0,0168 mol
Nombre de moles d'HBr: n = 0,0247 mol
Les 2 réactifs réagissants mole à mole, le réactif limitant est le 1-butanol
Etape 2: calculer le nombre de mole théorique de 1-bromobutane
Selon les coefficients stoechiométriques de la réaction, une mole de 1-butanol permet d'obtenir une mole 1-bromobutane. Si la réaction a un rendement de 100 %, on doit donc obtenir 0,0168 mol de 1-bromobutane.
D'où une masse théorique égale à m = 0,0168x137 = 2,30 g
Le rendement de la réaction est donc ρ = 1,6/2,3 = 0,69 soit 69 %
Données sur le 1-butanol
M= 74,12 g/mol
Masse volumique = 0,81 g/mL
Données sur le 1-bromobutane
M = 137 g/mol
Masse volumique =1,27 g/mL
Données sur l'acide bromhydrique
M = 80,9 g/mol
Masse volumique = 1,48 g/mL