Etablir le tableau d'avancement d'une réaction chimique
Le tableau d'avancement permet d'établir rapidement un bilan de matière à l'état initial, au cours de la réaction et à l'état final. A partir des quantités de matière initiales et de la stoechiométrie de la réaction, on en déduit le réactif limitant. L'avancement est ensuite utilisé pour le calcul numérique pour déterminer les quantités de matière finales des produits et des réactifs.
Définition de l'avancement de réaction
Pour remplir le tableau d'avancement, on commence par écrire et équilibrer la réaction bilan de la réaction.
Equilibrer la réaction consiste à mettre les coefficients stoechiométriques afin de respecter la conservation de la matière.
H2SO4 + 2NaOH → 2 Na+ + SO42- + 2H2O
Pour les réactions d'oxydo-réduction, vous pouvez consulter cette fiche pour des explications plus détaillées.
L'avancement de la réaction est défini selon la relation ci-desous. Il est représenté par la lettre grecque ξ et s'appelle Ksi. Son unité est la mole (mol).
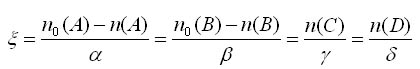
Il peut s'écrire sous une forme différentielle :
dξ = dn(A)/ α = dn(B)/ β etc...
On place ensuite dans le tableau, les quantités de matière de chaque espèce à l'état initial en fonction de l'avancement. Celui-ci étant généralement nul à l'état initial t=0, les quantités de matière des produits sont égales à 0.
D'où le tableau d'avancement :
| αA + | βB | → | γC + | δD | |
| A t = 0 | n0(A) | n0(B) | 0 | 0 | |
| A t | n(A) = n0(A) - α ξ | n(B) = n0(B) - β ξ | n(c)= γ ξ | n(D)= δ ξ | |
| A t final | nf(A) = n0(A) - α ξf | nf(B) = n0(B) - β ξf | nf(c)= γ ξf | nf(D)= δ ξf |
Exemple dans le cas d'un dosage acide base
| H2SO4 | + 2NaOH | → | Na2SO4 | + 2H2O | |
| A t = 0 | 2 moles | 3 moles | 0 | 0 | |
| A t | 2 - ξ | 3- 2ξ | ξ | 2ξ | |
| A t final | 2 - ξf | 3- 2ξf | ξf | 2ξf |
Détermination du réactif limitant
En reprenant la réaction de neutralisation de l'acide sulfurique H2SO4 par la soude NaOH, on peut aisément calculer le réactif limitant.
Puisque la réaction est totale, la réaction stoppera lorsque l'un des deux réactifs aura été entierement consommé.
Dans le cas de l'acide sulfurique on a : 2 - ξf = 0 soit ξf= 2 mol
Pour la soude on a : 3- 2ξf soit ξf= 3/2 = 1,5 mol.
L'avancement de la soude étant le plus faible, ce sera donc le réactif limitant.
En réinjectant l'avancement ξf= 1,5 mol dans le tableau, on peut calculer le nombre de moles de produits formés.
On obtient pour le sulfate de sodium : 1,5 mole et pour l'eau : 3 moles.
Côté réactif : on obtient bien entendu 0 mole pour la soude et 0,5 mole pour l'acide sulfurique.
Le taux d'avancement de la réaction
Il est défini comme étant le rapport de l'avancement de la réaction divisé par l'avancement maximal: τ = ξ/ξmax.
Lorsque la réaction n'est pas totale, on peut calculer le taux d'avancement final s'écrit τ = ξf/ξmax
Avec ξf et ξmax respectivement l'avancement final et maximal théorique.