Bombe calorimétrique de Berthelot
Mis au point par Berthelot au 19ème siècle, ce dispositif permet de mesurer la chaleur dégagée au cours d'une réaction.
Le calorimètre de Berthelot est un système constitué d'un récipient rempli d'eau dont on mesure l'élévation de la température lors de la combustion d'une masse connue d'échantillon.
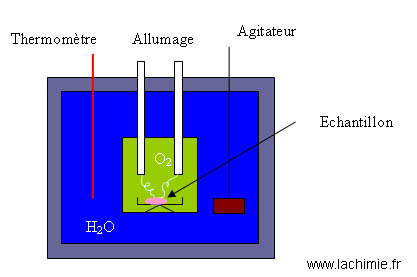
La combustion d'une masse connue d'un échantillon dont on connaît la capacité calorifique permet de déterminer la capacité calorifique du calorimètre.
Le calorimètre étant étalonné, il est ensuite possible de déterminer la chaleur de réaction d'un échantillon inconnu.
Détermination de la capacité calorifique du calorimètre
La capacité calorifique du calorimètre (également appelée valeur en eau du calorimètre) peut être aisément déterminée grâce à la dissolution d’un sel, tel que NH4Cl, dont on connait l’enthalpie standard de dissolution ∆dissH°. En supposant qu’il n’y a pas d’échange de chaleur avec l’extérieur (calorimètre parfait), la transformation est adiabatique. La relation entre la quantité de chaleur dégagée lors de la dissolution et l'ethalpie standard de dissolution s’écrit :
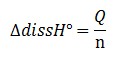
La quantité de chaleur s’écrit :
- ∆T la variation de la température lors de la dissolution du sel en °K
- Meau : la masse d’eau en Kg
- Ceau : la capacité calorifique de l’eau en J.K-1.Kg-1
- Ccal : la capacité calorifique du calorimètre en J.K-1.Kg-1