Corrigé du dosage de la limonade
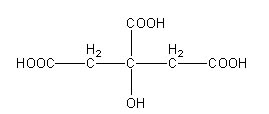
1- formule développée
 2- le but de dégazage est d’enlever le CO2 présent dans la limonade. En effet le CO2 est un acide (couple acide base CO2,H2O/HCO3-). Il serait donc neutralisé en même temps que l’acide citrique et fausserai le résultat.
2- le but de dégazage est d’enlever le CO2 présent dans la limonade. En effet le CO2 est un acide (couple acide base CO2,H2O/HCO3-). Il serait donc neutralisé en même temps que l’acide citrique et fausserai le résultat.
3- On utilise une pipette jaugée de 50 mL
4- a)
courbe 1 : H3A
courbe 2 H2A-
courbe 3 : HA2-
courbe 4 : A3-
4b) d’après la relation pH = Pka + log[A-]/[AH], pH = Pka lorsque [AH] = [A-].
Cette relation est vérifiée à l’intersection des courbes de distribution de la forme acide et de la forme basique.
On obtient pour les 3 acidités de l’acide citrique : Pka1 = 3,1, Pka2 = 4,75, Pka3 = 6,4.
4c)
H3A + OH-→H2A- + H2O
H2A- + OH- →HA2- + H2O
HA2- + OH- → A3- + H2O
4d) On obtient un seul saut de pH car les pka des 3 acidité sont proches les uns des autres.
5a) à l’équivalence la totalité de l’acide citrique est neutralisée : H3A + 3 OH- → A3- + 3H2O
5b) à l’équivalence nH3A = nOH-/3
soit CH3A = COH-VOH-VH3A/3= 0,1x12/(3x50)=8.103 mol/L
6a) l’indicateur coloré doit avoir sa zone de virage dans la zone du saut de pH
6b) à l’équivalence le pH = 9 (détermination graphique par la méthode des tangentes). La phénolphtaléine est donc le seul qui convienne parmi les 4 indicateurs colorés proposés.
7) Le Pka varie avec la température. Celle-ci doit donc être stable au cours de temps. Les pKa sont habituellement mesurés à 25°C.
Voir l'énoncé du dosage de la limonade