Dosage de NH3 par HCl en conductimétrie
Intérêt de la méthode
Le dosage de l'ammoniaque par la soude en conductimétrie est une méthode analytique qui présente plusieurs avantages, notamment sa simplicité, sa rapidité et son efficacité.
L'ammoniaque NH3 est une base faible qui peut être facilement dosée en solution par une solution de soude (NaOH).
Lorsqu'une solution de NaOH est ajoutée à un échantillon contenant de l'ammoniaque, l'ammoniaque réagit avec la soude pour former de l'ammonium (NH4+) et des ions Cl-
selon la réaction de neutralisation :
NH3 + HCl → NH4+ + Cl-.
La réaction modifie la conductivité de la solution, ce qui permet de suivre son évolution en temps réel à l'aide d'un conductimètre.
La conductimétrie est une méthode sensible et rapide.
De plus, elle permet de suivre la réaction en continu.
Mode opératoire et données d'acquisition
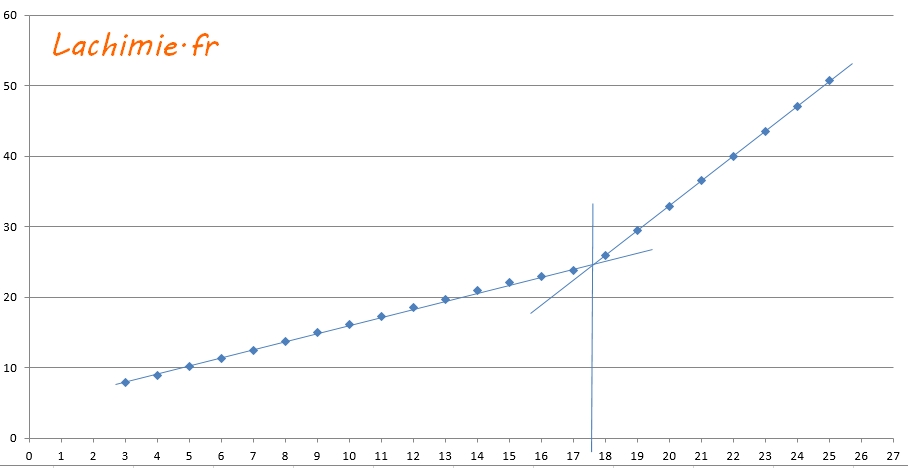
10 mL d'une solution aqueuse d'ammoniaque de concentration d'environ 0,1 mol/L est titrée par de l'acide chlorhydrique à 0,1 mol/L. La solution d'ammoniaque est placée dans un bécher de 400 mL. On ajoute 200 mL d'eau pour minimiser l'effet de dilution.
| V en mL | pH |
|---|---|
| 3 | 7,86 |
| 4 | 8.93 |
| 5 | 10,11 |
| 6 | 11,29 |
| 7 | 12,5 |
| 8 | 13,73 |
| 9 | 14,94 |
| 10 | 16,17 |
| 11 | 17,26 |
| 12 | 18,52 |
| 13 | 19,68 |
| 14 | 20,94 |
| 15 | 22,04 |
| 16 | 23,01 |
| 17 | 23,74 |
| 18 | 25,92 |
| 19 | 29,48 |
| 20 | 32,91 |
| 21 | 36,61 |
| 22 | 40 |
| 23 | 43,48 |
| 24 | 47,12 |
| 25 | 50,7 |
 Retour au début du cours
Retour au début du cours
