Photométrie de flamme
Principe de la photométrie de flamme
Une parte des ions soumis à la chaleur de la flamme passent dans un état excité. Le retour à l'état fondamental des électrons de la couche externe s'effectue avec émission caractéristique de l'ion en présence.
Dans la solution, le cation est sous une forme hydratée avec un contre-ion. Dans la flamme, le sel est d'abord déshydraté avant d'être liquéfié puis vaporisé. Le cation et l'anion sont ensuite dissociés par la chaleur de la flamme.
La photométrie de flamme repose sur le fait que l'intensité de l'émission est proportionnelle au nombre d'atomes retournés à l'état initial. La lumière émise est donc proportionnelle à la concentration de l'échantillon.
La loi de Maxwell - Boltzmann permet de déterminer les rapports des populations dans un état fondamental et un état excité en fonction de la température.
g le rapport statistiques des état 1 et 0
k constante des Boltzmann = 1.38x10-23J/K
∆E: écart énergétique en Joule
T: la température en K
Exemple du sodium :
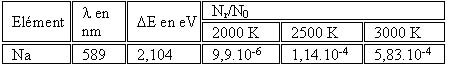
Les ions généralement dosés par photométrie de flamme sont le Na, K, Li, Ba et Ca.
A voir également :
Le photomètre de flamme
Les tampons d'ionisation
L'absorption atomique