Lexique de chimie
Le lexique donne une courte définition des termes fréquemment employés en chimie
Liste des définitions du lexique
Acides gras: Ce sont des acides carboxyliques estérifiés sous forme de triglycérides. Ce sont les constituants des huiles végétales et des graisses animales. Ils peuvent être saturés (aucune double liaison), mono-insaturés (1 double liaison) ou poly-insaturés (plusieurs doubles liaisons).
Acrylique: polymères issus de l'acide propénoïque aussi appelée acide acrylique
Actinides: famille d'éléments chimiques dont le numéro atomique varie de 59 à 103.
Acylation: réaction qui consiste à introduire une groupement acyle ( -COR) sur une molécule. Le nom du groupement acyle est issu de l'acide carboxylique correspondant (l'acide acétique donne le groupement acétyl de formule - COCH3)
La réaction de Friedel-Crafts permet d'effectuer une acylation.
Adiabatique: sans échange de chaleur
Alcaloïdes: Composés organiques hétérocycliques azotés issus des plantes. En raison de leur forte action métabolique, nombreux de ces composés sont toxiques pour l'homme comme la strychnine. D'autres ont été utilisés à des fins thérapeutiques (morphine, quinine...). La caféine est un alcaloïde.
Alcoolate: base conjuguée d'un alcool. Leur synthèse peut être effectuée par la réaction du sodium sur l'alcool.
Exemple: synthèse de l'éthanoate de sodium
2C2H5OH + 2Na → 2C2H5O- + 2Na+ + H2
Allotropie: lorsque qu'un composé existe sous différentes formes. Exemple: le carbone peut avoir la structure du diamant ou du graphite.
Alkylation: Réaction qui consiste à introduire un groupement alkyle (chaîne carbonée issue de l'alcane correspondant) sur une molécule.
Le nom du groupement alkyle est issu de l'alcane correspondant: le propane donne le groupement propyle de formule CH3-CH2CH2-
La réaction de Friedel-Crafts permet d'effectuer une alkylation.
Amalgame: solution solide (alliage) d'un métal dans le mercure. Certains amalgames sont utilisés pour réaliser les plombages dentaires.
Amphotère: substance ayant des propriétés à la fois basique et acide. Exemple, l'eau est un composé amphotère.
Anode: électrode où se produit l'oxydation
Anisotrope: lorsque les propriétés diffèrent selon la direction
Arène: famille de molécules issus du benzène. Ce sont des hydrocarbures aromatiques. Parmi eux les HAP qui sont des polluants issus de la combustion des carburants automobiles.
Exemple d'arènes: le benzène, le naphtalène, le toluène...
Azoïque: produit ayant une structure du type -N=N-
Bauxite: minerai contenant de l'aluminium
Bromation: réaction chimique qui consiste à remplacer un atome d'hydrogène par un atome de brome.
Capacité calorifique molaire : Notation Cv (à volume constant) ou Cp (à pression constante) en J.mol-1.K-1 correspond à la chaleur nécessaire pour élever la température d'un degré 1 mole de substance
Carbanion: atome de carbone portant une charge -
Carbocation: atome de carbone portant une charge +
Catalyse hétérogène: se dit lorsque le catalyseur employé est dans une phase différente des réactifs.
Catalyseurs: substance qui augmente significativement la vitesse de réaction et qui est restitué en totalité en fin de réaction. Exemple: catalyse acide avec les protons H+
Cathode: électrode où se produit la réduction
Chlorure d'aluminium: AlCl3. Composé utilisé comme acide de Lewis.
Conditions standard: T = 298 K, P = 105 Pa, []=1mol/L
Constante d'Avogadro: NA = 6,02.1023 mol-1
Constante de Faraday: F= 96480 C.mol-1. Elle correspond à la charge d'une mole d'électrons
Constante des gaz parfaits: R = 8,314 J.K-1.mol-1 dans les conditions standard. Elle est issue de l'équation des gaz parfaits.
Coulomb: Unité du système international (SI) de charge électrique. C'est la quantité d'électricité traversant une section d'un conducteur parcouru par un courant d'intensité de 1 ampère pendant 1 seconde. 1A = 1C/s
Dosage: le dosage constiste à déterminer la concentration ou la quantité de matière d'une espèce chimique. Il peut s'effectuer par étalonnage ou par titrage.
Eau de chaux: solution aqueuse d'hydroxyde de calcium Ca(OH)2
Effet bathochrome : le maximum d'absorption se déplace vers les grandes longueurs d'ondes
Effet Hypsochrome : déplacement du maximum d'absorption vers les faibles longueurs d'onde
Effet hyperchrome : augmentation de l'absorbance
Effet hypochrome : diminution de l'absorbance
Equation différentielle : Soit F(x,y) , la variation infinitésimale de F s'écrit selon la différentielle:
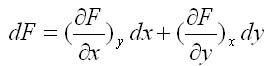
Elément du bloc d: éléments chimiques également appelés métaux de transition. Ils sont caractérisés par une configuration électronique du type ns2 np6 nd(1 à 10) (n+1)s2
Eléments du bloc f: ce sont les lanthanides et les actinides
Eléments du bloc p: élément ayant une configuration électronique du type s² p(1 à 6). Cela correspond aux éléments des colonnes de 13 à 18 sur le tableau périodique.
Elément du bloc s: correspond aux métaux alcalins et alcalino-terreux, de l'hélium et de l'hydrogène. Leur configuration électronique est du type ns(1 à 2)
Entropie: Noté S elle correspond à l'état de désordre du système. Elle est faible pour les solides et augmente pour les liquides et les gaz.
Fonction d'onde
La fonction d'onde φ est fonction de coordonnées dans l'espace qui permet de calculer la densité de probabilité de l'électron φ² dans un espace déterminé.
φ² = dP/dV
dP: probabilité de présence dans le volume dV
Fraction molaire: c'est le rapport du nombre de mole ni sur le nombre de moles total n. Elle s'écrit xi = ni/n
Glace sèche: dioxyde de carbone à l'état solide (T° de solidification: -79°C)
Groupe: un groupe correspond aux éléments chimiques contenus dans un colonne verticale de la classification périodique. Il y a donc 18 groupes. Les groupes 3 à 12 forment les éléments du bloc d.
Iodation: réaction chimique qui consiste à remplacer un atome d'hydrogène par un atome d'iode.
Ion oxonium: ion H3O+
Isobare : à pression constante
Isochore : à volume constant
Isotope: Elément chimique ayant le même nombre de protons mais un nombre de neutrons différent. Exemple 12C et 13C. Voir les abondances isotopiques.
Isotrope: Lorsque les propriétés sont identiques quelques soient la direction
Joule: Unité du système international (SI) d'énergie. Symbole du joule: J
Kelvin: Unité du système international de température
Laitier: déchets issus de la fabrication des métaux (oxydes métalliques, silicates...)
Laiton: alliage de cuivre
Liqueur de Fehling: Solution à base d'ions cuivriques servant de test pour distinguer les cétones des aldéhydes car seules ces dernières réduisent la liqueur de Fehling et donnent un précipité rouge.
Premier principe de la thermodynamique: dans toute transformation, il y a conservation de l'énergie.
Lumière polarisé: lumière dont les ondes sont dans un même plan
Longueurs de liaison: distance moyenne entre chaque atome. Elles varient suivant l'environnement de chaque atome. Quelques exemples de longueurs de liaisons:
C-C: 1,54 Angström
C=C: 1,34 Angström
C≡C: 1,20 Angström
C-H: 1,07 Angström
C-O: 1,43 Angström
C-N: 1,47 Angström
O-H: 0,96 Angström
Masse volumique: C'est la masse du composé divisé par son volume. Elle est notée ρ et vaut ρ = m/V.
Molalité: elle est notée m (à ne pas confondre avec la masse) et est égale à:
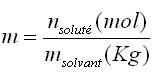
Nucléon: particule du noyau: proton, neutron
Oxacide: Acide constitué d'oxygène: H2SO4, HNO3
Période d'un élément radioactif : Aussi appelée demi-vie, c'est le temps au bout duquel la moitié des éléments s'est désintégrée.
Période: ligne horizontale du tableau périodique
Produit ionique de l'eau: Ke = [H+][OH-]= 10-14
Racémique: signifie dans les mêmes proportions
Réactif de Tollens: test pour différencier les aldéhydes des cétones. Les aldéhydes forment un miroir d'argent. Les cétones ne réagissent pas.
Réactif de Grignard: organométallique de formule RMg-X obtenu en faisant réagir un alcane halogéné sur du Mg métallique. L'éther est généralement utilisé comme solvant car il permet de stabiliser l'organomagnésien.
Réaction de condensation: réaction qui s'accompagne d'une perte d'eau
Réaction de dismutation : réaction où une augmentation et une diminution du degré d'oxydation se produit sur une même espèce chimique. Exemple : 2 CO → CO2 + C
L'atome de carbone passe du degré d'oxydation - 2 à - 4 et 0
Titrage: le titrage est un type de dosage où l'on fait réagir l'analyte à doser avec un réactif titrant. L'espèce à doser est détruite au cours de la réaction.
Relargage: consiste à diminuer la solubilité d'une espèce chimique dans un solvant en saturant le solvant à l'aide d'un sel soluble.
Salpêtre: nitrate de potassium
Saumure: solution aqueuse concentrée en NaCl
Second principe de la thermodynamique : une transformation spontanée n'est possible que si l'entropie totale du système et du milieu extérieur est nulle ou augmente
Unité du système international (SI):
Longueur: le mètre (m)
Masse: le kilogramme (Kg)
Température: le kelvin (K)
Intensité électrique: l'ampère (A)
Volume d'un gaz: dans les conditions normales (standard), le volume molaire d'un gaz vaut 22,4 L.
