Expression de la Loi d'Arrhénius
Généralement, la vitesse d'une réaction chimique augmente avec la température. En reprennant la relation de la vitesse v = k[A]m[B]n, on en déduit que c'est la constante de vitesse k qui varie avec la température.
Cette variation est donnée par une loi empirique : la loi d'Arrhénius:
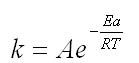
avec :
- k: constante de vitesse
- A: la constante d'Arrhénius
- Ea:l'énergie d'activation en kJ/mol. Elle représente l'énergie nécessaire pour que la réaction puisse de produire. Elle est de l'ordre de de 50 à 100 kJ/mol
- R: la constante des gaz parfait en J.K-1.mol-1. Elle est égale à 8,31 J.K-1.mol-1
- T: la température en Kelvin K
k et A ont la même unité : celle-ci dépend de l'ordre de la réaction
La loi peut également s'écrire sous la forme logarithmique. Cette forme est utile pour déterminer l'énergie d'activation. La relation peut donc s'écrire sous la forme :
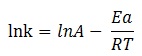
En pratique, on commence par déterminer la constante de vitesse à deux températures différentes. On trace ensuite la courbe lnk en fonction de 1/T : on obtient une droite dont le coefficient directeur
est égal à -Ea/R. Il est alors possible de calculer l'énergie d'activation.
Pour terminer le chapitre sur la cinétique chimique, il est également utile de déterminer graphiquement la vitesse de réaction à un temps t.
Détermination graphique