Mécanismes réactionnels des dérivés halogénés
Les mécanismes réactionnels mettant en jeu les dérivés halogénés sont principalement liés à la forte polarisation de la liaison entre le carbone et l'halogène. Cette polarisation est due à la forte électronégativité des halogènes (X)
La réactivité des halogénoalcanes augmente du fluor à l'iode.
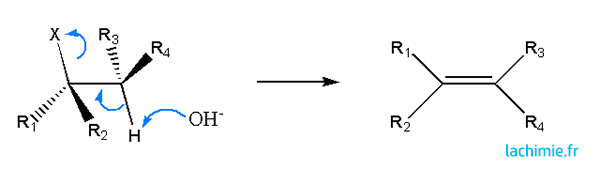
Réaction d'élimination : Les atomes d'hydrogènes en B d'une liaision C-X est mobile et peut être arraché par une base forte. Cette réaction d'élimination conduit à la formation d'un alcène. En présence d'hydrogènes sur 2 atomes adjacents à la liaison C-X, l'alcène le plus substitué sera formé préférentiellement (règle de Zaïtsev).
Les réactions de substitution nucléophile
En raison de son côté électrophile, le carbone lié à l'halogène peut subir une attaque nucléophile avec subtitution de l'halogène.
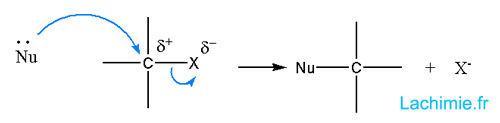
Cette réaction peut être séparée selon la vitesse et l'ordre de la réaction en 2 catégories : SN1 et SN2.
Réaction SN1
Les réactions du type SN1 obéissent à une loi de vitesse V= -d[A]/dt = k[A] avec [A] la concentration du dérivé halogéné.
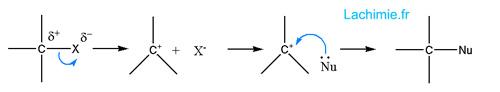
Elle se déroule en 2 étapes :
- départ de l'halogène et formation d'un carbocation (lente)
- attaque du nucléophile (rapide)
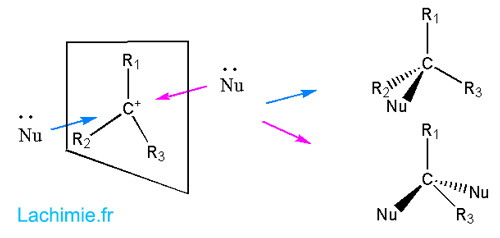
A noter que le carbocation est de géométrie plane et peut être attaqué de chaque côté du plan. On obtient donc une racémisation si le composé formé possède 4 substituants différents.
La réaction SN1 sera d'autant plus facilitée que le carbocation formé est stable. Les solvants protiques polaires seront également favorables à une SN1 car ils aident la rupture de la liason C-Nu et stabilisent le carbocation.
Réaction SN2
Les réactions de type SN2 s'effectuent en une seule étape et obéissent à une loi de vitesse d'ordre 2 : V= k[A][Nu] avec [Nu] la concentration en nucléophile.
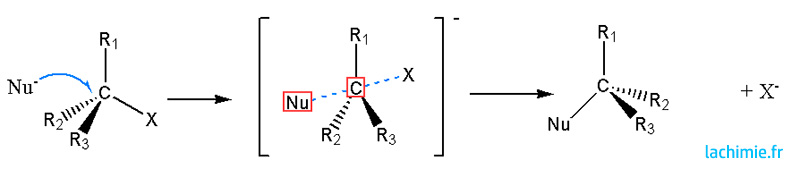
On observe une inversion de la configuration R à S ou inversement. Les solvants aprotiques sont favorables à ce mécanisme
Les réactions d'éliminations
Elles obéissent aux mêmes lois de vitesse que les réactions de substitution et sont en compétition avec elles. L'élimination est favorisé lorsque le réactif est très basique ( soude concentrée par exemple). Un réactif nucléophile conduira plutôt à une réaction de substitution.
Elimination E1
Les alcènes formés par élimination d'un proton respecte la règle de Zaïtsev: les plus substitués seront majoritaires. Comme pour la SN1, le carbocation plan entraîne l'absence de stéréospécificité. Elle est favorisée par les solvants protiques.
Loi de vitesse V = k[A]
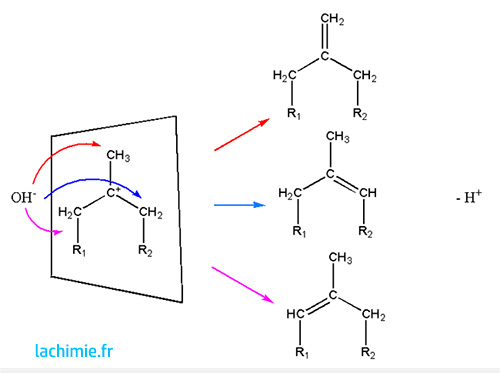
Elimination E2
Dans ce cas , la réaction est stéréospécifique et conduit à des configurations différentes. La règle de Zaïtsev est également valable. Les solvants aprotiques favorise ce mécanisme.
Loi de vitesse : V= k[A][Nu]