Réactivité des alcènes et mécanismes
Structure des alcènes
Les alcènes sont des composés acycliques comportant au moins une double liaison >C = C<
Ils ont pour formule générale : Cn H2n
L'alcène le plus simple est l'éthène couramment appelé éthylène de formule C2H4
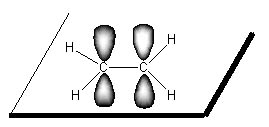
Les carbones ont une hybridation sp2. La double laison est formée par recouvrement de l'orbitale p non hybridée. Ce recouvrement implique que la molécule d'éthène est plane et qu'il n'y a pas de rotation possible de la double liaison. Cela entraine également les isoméries Z et E des composés éthylèniques.
Additions électrophiles
C'est le type de réaction le plus important en nombre et intérêt industriel.
Addition d'un hydracide (HCl par exemple)
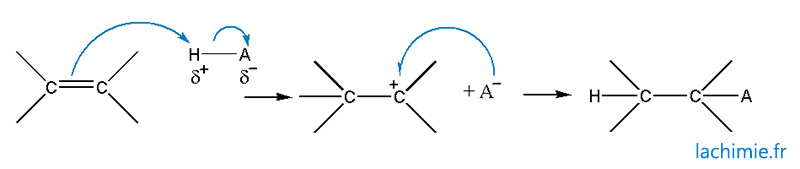
Elle conduit à une racémisation des molécules formées mais respecte les règles de régiosélectivité de Markovkinov. Le composé majoritairement formé est celui dont le carbocation est le plus stable.
Addition de dihalogène (Br2 par exemple)
Le mécanisme est légèrement différent et passe par un carbocation cyclique. La réaction devient stéréospécifique.
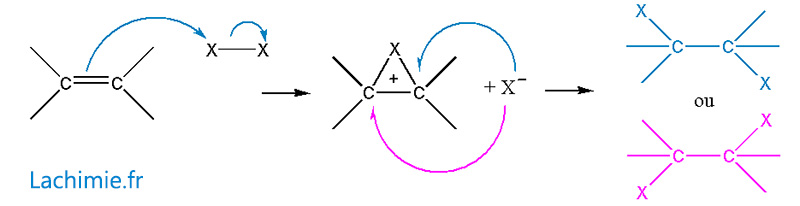
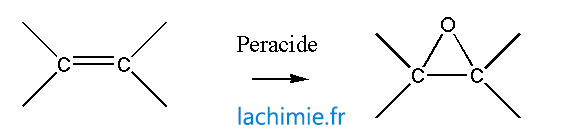
Autres réactions sur les alcènes
L'oxydation douce par des peracides conduit à la formation de peroxyde.
Une oxydation forte par le permanganate chaud entraine la formation d'aldéhydes ou de cétones généralement oxydées à leur tour pour donner un acide carboxylique.
L'oxydation par l'ozone permet de former des aldéhydes et des cétones (réaction d'ozonolyse).
