Réactivité et structure des alcynes - triple liaison
Structure des alcynes
Les alcynes sont des composés acycliques comportant au moins une triple liaison entre 2 atomes de carbone > C ≡ C <. Celle ci est constituée d'une liaison σ et de deux liaisons π.
Ils ont pour formule générale : Cn H2n-2
L'alcyne le plus simple est l'éthyne de formule C2H2. Il est couramment appelé acéthylène. C'est un hydrocfarbure à l'état de gaz dans les conditions habituelles de température et de pression. Il est notamment utilisé dans l'industrie pour alimenter les chalumeaux.
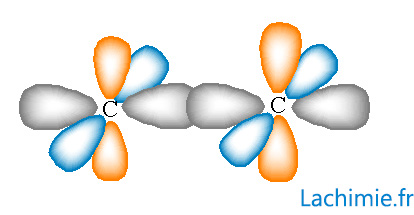
Les carbones ont une hybridation sp (orbitale de couleur grise sur le dessin). La triple laison est formée par recouvrement des orbitales p non hybridées repésentées ici en orange et en bleu.
Les alcynes sont moins réactifs que les alcènes suite à la longueur de liaison plus courte qui entraine une plus faible liberté des électrons des liaisons π mais leur comportement reste similaire. A noter que les alcynes vrais, lorsque la triple liaison est en bout de chaine, ont une réactivité supplémentaire due à la présence de l'atome d'hydrogène en bout de chaine.
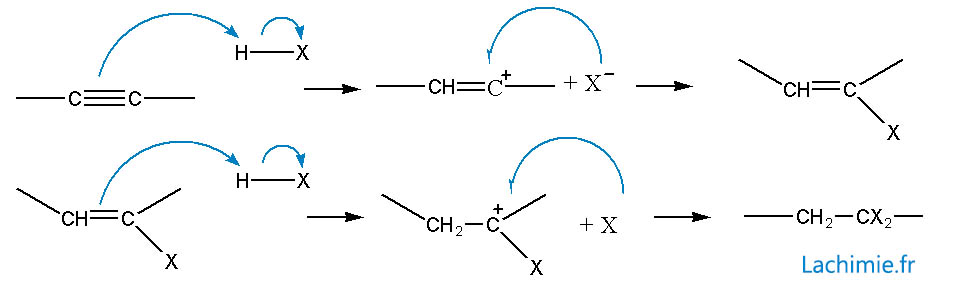
Additions électrophiles
L'addition d'un hydracide réagit sur la triple liaison comme pour les alcènes. La seconde étape est orientée préférentiellement vers la formation du carbocation -CH2-CX+- qui est stabilisé par la délocalisation des doublets de l'halogène.
Addition d'eau
Elle s'effectue en milieu acide avec un catalyseur à chaud.
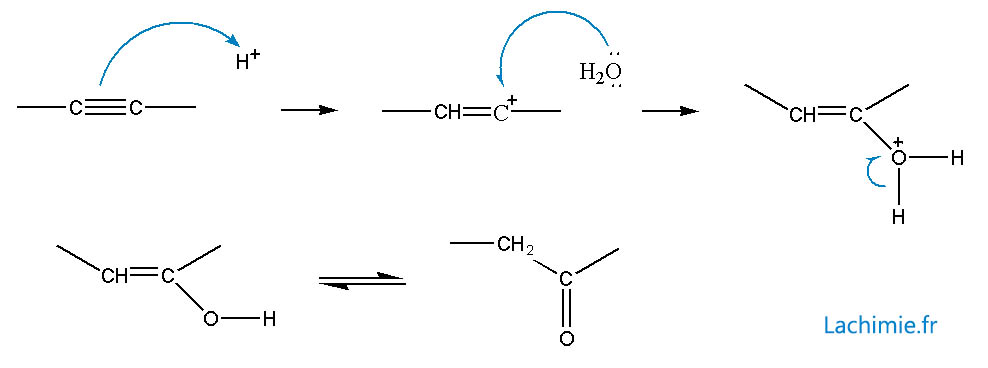
Mécanisme avec les alcynes vrais
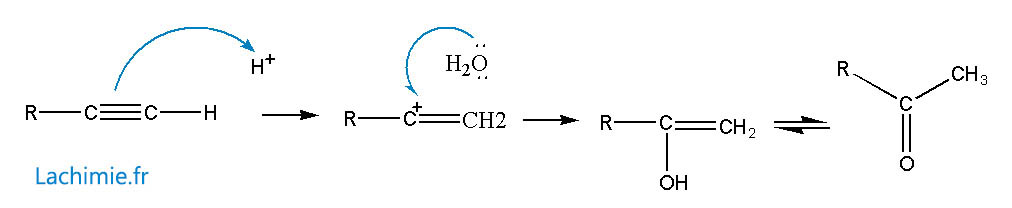
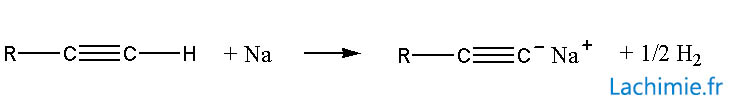
Mobilité de l'hydrogène
L'hydrogène des alcynes vrais est mobile et peut être "arraché" par les métaux alcalins, certains métaux tels que le cuivre et les bases fortes. La réaction donne naissance à un carbanion très réactif.