Les synthèses magnésiennes et principales réactions
La préparation d'un organomagnésien s'effectue en faisant réagir du magnésium solide sous forme de poudre sur un dérivé halogéné en milieu strictement anhydre. Le solvant est généralement un éther ou du tétrahydrofuranne (THF) dont les doublets de l'hydrogène solubilisent et stabilisent l'organomagnésien formé. Ces réactions portent également le nom de Grignard issu du chimiste français qui en a fait la découverte.
Formule générale: R-Mg-X
Conditions opératoires
En TP de chimie, on utilise le plus souvent un dérivé bromé avec de l'éther diéthilique anhydre. Toutefois, en raison de la forte inflammabilité de ce dernier, il est désormais possible d'utiliser des solvants moins inflammables et peu toxiques. C'est le cas du cyclopentylméthylether.
Tous les réactifs et la verrerie doivent être parfaitement anhydres. Pour cela les solvants sont déshydratés à l'aide de tamis moléculaire ou de sodium solide. La verrerie est séchée à l'étuve tout comme le magnésium. Le montage à reflux est protégé de l'humidité extérieure grâce à une garde contenant du chlorure de calcium anhydre. Les ajouts de réactifs s'effectuent par le biais d'une ampoule de coulée pour éviter de faire entrer de l'humidité dans le montage.
La réaction est assez difficile à amorcer. Un léger chauffage est parfois nécessaire et l'addition de réactif doit être lente. Une fois démarée, on continue l'ajout de réactif en goutte à goutte. Le magnésien formé ne peut pas être extrait du ballon. Il n'y a donc pas d'autres alternatives que de continuer la réaction dans le ballon où celui-ci a été synthétisé.
Propriétés et réactivité
Les organomagnésiens R-MgX présentent une polarisation de la liaison. La chaîne carbonée R aura donc un rôle de nucléophile dans les synthèses.
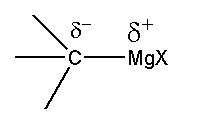
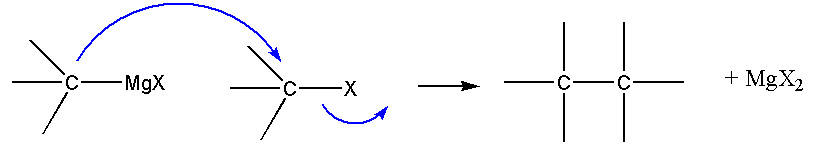
- substitution nucléophile :
- addition nucléophile avec une double liaison polarisée (fonction carbonyle par exemple >C=O). C'est le cas par exemple avec les chlorures d'acide (voir plus bas pour le mécanisme)
Résultats des principales réactions magnésiennes (éventuellement suivies d'une hydrolyse):
R-MgX + 1/2O2 → R-OH alcool primaire secondaire ou tertiaire
R-MgX + CO2 → R-COOH
R-MgX + H2O → hydrocarbure RH
R-MgX + aldéhyde → alcools secondaires
R-MgX + cétone → alcools tertiaire
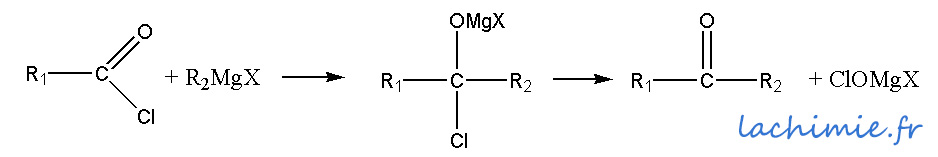
La réaction d'un organomagnésien R-MgX avec du chlorure d'acide (RCOCl) conduit à une cétone. Cette dernière réagit à son tour avec le magnésien pour former un alcool tertiaire.
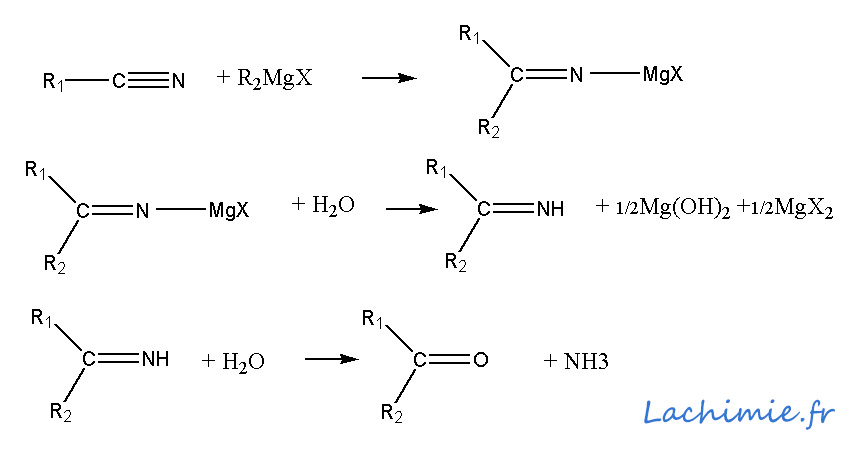
Avec un nitrile, on obtient après formation du magnésien, une imine instable qui est hydrolysée pour donner une cétone.