Hybridation du carbone
L'hybridation du carbone permet d'expliquer la géométrie des molécules organiques et la nature des liaisons au sein des molécules organiques.
Structure électronique du carbone
L'atome de carbone a 6 électrons dont 4 sur sa couche externe. Sa structure électronique est la suivante:
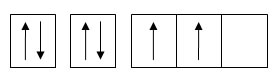
Cette configuration électronique ne permet pas d'expliquer la tétravalence du carbone. En effet, les liaisons du carbone forment un tétraèdre et sont parfaitement équivalentes. Il faut donc envisager le carbone dans un état excité avec la formation d'orbitale hybride.
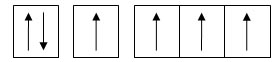
La combinaison linéaire d'orbitale atomique (CLOA) conduit à la formation d'orbitales hybrides.
Hybridation du carbone
Hybridation sp3: les orbitales p et s de la couche externe du carbone vont se recombiner pour former 4 orbitales hybrides sp3. La géométrie de cet état d'hybridation est un tétraèdre et correspond au groupe d'arrangement AX4 dans la théorie de Gillespie (VSEPR). Les liaisons forment entre elles un angle de 109,28°.
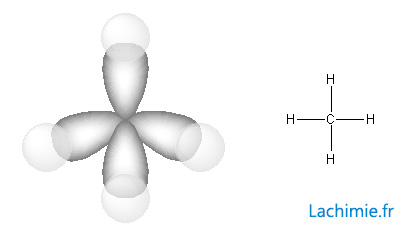
Exemple: le méthane
Le carbone de la molécule de méthane forme 4 liaisons simples avec 4 atomes d'hydrogène par recouvrement des 4 orbitales sp3 avec les orbitales 1s de l'hydrogène.
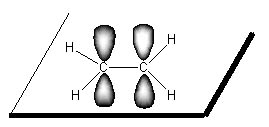
Hybridation sp2: cet état permet la formation des doubles liaisons par recouvrement latéral des orbitales p non hybridées. Les 3 orbitales hybrides sp2 sont coplanaires (dans le même plan) et forment entre elles un angle de 120°. La géométrie correspond au groupe AX3.
Exemple: l'éthène C2H4
Le recouvrement axial de 2 orbitales sp2 forme un simple liaison σ et le recouvrement latéral une double liaison π. La molécule est donc plane et rigide. La rotation autour de l'axe C=C est impossible.
Hybridation sp: C'est l'état d'hybridation permettant la formation d'une triple liaison. Une orbitale s et une orbitale p se combinent pour former 2 orbitales sp situées sur le même axe. Elles permettent la formation des liaisons σ. Les 2 orbitales p non hybrides complètent la triple liaison par recouvrement latéral et formation de 2 liaisons π . La géométrie correspond au groupe AX2. la molécule formée est linéaire et rigide ( pas de rotation possible)
