La chromatographie d'exclusion (ou perméation de gel)
Ce type de chromatographie est utilisé pour la séparation des macromolécules telles que les protéines. Ici seuls la taille de la molécule et son encombrement stérique influent sur la vitesse d'élution. Lorsque que la phase stationnaire hydrophile avec une phase mobile aqueuse, on parle de permation de gel.
Principe de la chromatographie d'exclusion stérique (SEC)
Les particules de la phase stationnaire présentent des pores de différentes tailles où pourront se loger les molécules de l'échantillon. Il n'y a pas d'interactions entre la phase stationnaire et les composés à éluer. La phase mobile peut avoir une influence sur l'encombrement stérique de la macromolécule et influer sur l'ordre d'élution. Il est donc important de fixer correctement les conditions d'élution comme le pH ou la force ionique de la phase mobile. On utilise pour cela des étalons.
Ainsi les molécules sont plus ou moins retenues suivant leur taille et leur possibilité de pénétrer dans les pores de la résine.
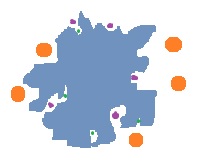 Les grosses molécules (en orange sur le dessin) qui ne peuvent pas rentrer dans les pores ne sont pas retenues. Les plus petites molécules (en vert) pénètrent plus profondément dans les pores. Les solutés sont donc élués dans l'ordre des masses molaires décroissantes.
Les grosses molécules (en orange sur le dessin) qui ne peuvent pas rentrer dans les pores ne sont pas retenues. Les plus petites molécules (en vert) pénètrent plus profondément dans les pores. Les solutés sont donc élués dans l'ordre des masses molaires décroissantes.
Le matériel est identique à celui de l'HPLC classique. Les détecteurs les plus appropriés sont ceux à barette de diode et ceux à réfractomètre. Les détecteurs UV peuvent également être employés avec le risque que certaines molécules ne soient pas détectées en raison de leur absence de chromophore. La colonne doit être choisie en fonction de la taille des pores et des molécules à analyser. Pour les protéines, on choisit généralement des pores de 300 Armstrong
