Solvants HPLC: lequel choisir pour une bonne séparation ?
Polarité des solvants utilisés en HPLC
Les solvants sont classés du plus polaire au moins polaire avec une échelle
(approximative) de 1 à 10.
- eau (10)
- DMSO (7)
- Acétonitrile (6)
- Acide acétique (6)
- méthanol (5)
- Ethanol (4)
- Chloroforme (4)
- Propan-2-ol (4)
- THF (4)
- Propanol (4)
- Fluorobenzene (3)
- Chlorure de méthylène (3)
- Bromoethane (2)
- Chloroethane (1)
- Cyclohexane (0)
- Isooctane (0)
Interactions solvant - soluté
- interactions ionique en présence de moment dipolaire sur le soluté
et le solvant
- interactions de dispersions
- interactions diélectriques qui permettent la dissolution des solutés
ioniques dans les solvants polaires
- interactions par liaisons hydrogènes.
Solvant et élution
Afin de prévoir l'ordre d'élution des composés, il est nécessaire de connaître le type de colonne, la polarité des produits chimiques en fonction de leur famille et la force éluante de la phase mobile (classement proche de la polarité du solvant)
Il est souvent nécessaire en HPLC de faire des mélanges de solvants pour obtenir la polarité souhaitée. On utilise pour cela des abaques de force éluante ou des règles d'isoéluance.
Les solvants doivent bien entendu être miscibles entre eux. La table ci-dessous indique la miscibilité des principaux solvants.
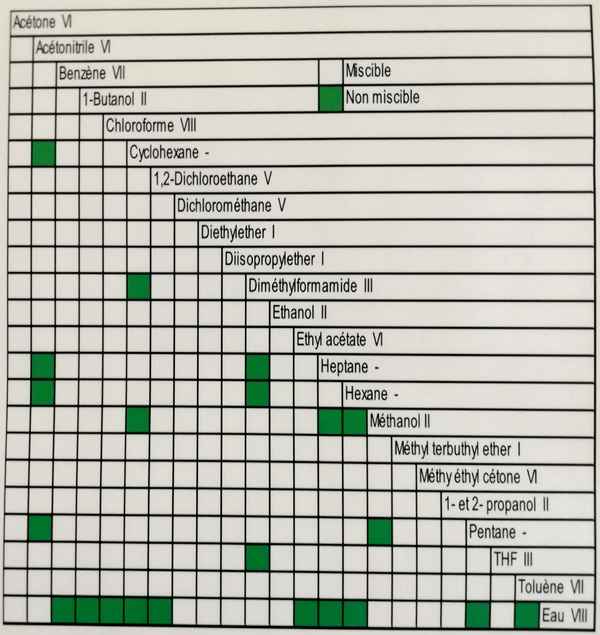
Les chromatographes munies de plusieurs voies permettent de faire varier les proportions d'un solvant en cours d'élution. Plus coûteux à l'achat, ce type d'appareillage offre une souplesse d'utilisation très intéressante.
Il est bon de rappeler que les solvants doivent avoir une qualité HPLC et qu'ils doivent être dégazés. Lorsque l'eau est utilisée comme solvant elle doit avoir une résistivité de minimum de 18Mohms. Le dégazage est peut être effectué par barbotage dans l'hélium mais il existe également des dégazeurs plus sophistiqués dans le commerce.
Le choix du solvant dépend également de la colonne utilisée : type de colonne, domaine pH d'utilisation...
Longueur d'onde minimale d'utilisation du solvant
De nombreux détecteurs HPLC sont de type UV basés sur la loi d'absorbance de Beer-Lambert. Il est donc nécessaire de connaître les longueurs d'onde minimale d'utilisation des solvants courants.
Isooctane : 197 nm
Cyclohexane : 200 nm
Tétrachlorure de carbone : 265 nm
Propan-2-ol : 205 nm
Ethanol : 210 nm
Acétonitrile : 190 nm
DMSO : 268 nm
Méthanol : 205 nm
