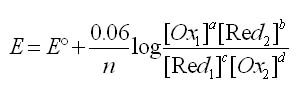Equation de Nernst
L'équation de Nernst permet de calculer le potentiel d'un couple rédox
Equation de Nernst : définition
Soit la demi-pile : aOx + ne- ⇌ bRed
L'équation de Nernst s'écrit:
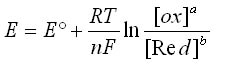
Avec:
- E: le potentiel en Volt
- E°: le potentiel standard en Volt
- R: constante des gaz parfaits - R = 8,3145 J·mol-1·K-1
- T: la température en Kelvin (K)
- F: la constante de Faraday = 96 485 C.mol-1
- N: le nombre d'électron échangés
Rappel mathématique : fonction logarithme de base a: logax = lnx/lna
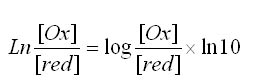
On en déduit le terme (RT/F).ln10 = 0.059
Equation de Nernst dans les conditions standard
L'équation de Nernst s'écrit dans les conditions standard (P= 1atm, T° = 25°C)
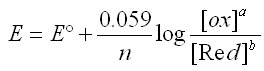 A savoir:
A savoir:
- Pour les corps purs solides, la concentration est remplacée par «1»
- La relation de Nernst est issue du calcul de l'enthalpie libre du système ∆G =∆H - T∆S
Exemples :
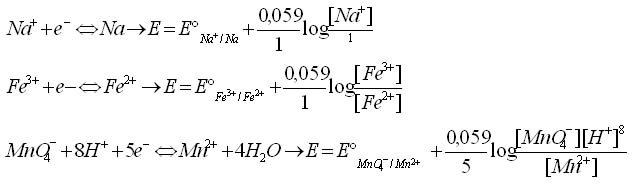
Equation de Nernst pour un système rédox
aOx1 + bRed2 + ne- ⇌ cRed1 + dOx2
L'équation de Nernst s'écrit: