Manganimétrie, dosage d'oxydo-réduction
La manganimétrie est une méthode de dosage d'oxydoréduction utilisant l'ion permanganate MnO4- . Le manganèse, de symbole chimique Mn, porte le numéro atomique 25 avec une configuration électronique 4s23d5. Il possède divers degrés d'oxydation comme indiqué sur le diagramme de Frost ci-dessous dont la stabilité en fonction du pH est donnée sur le diagramme de Pourbaix.
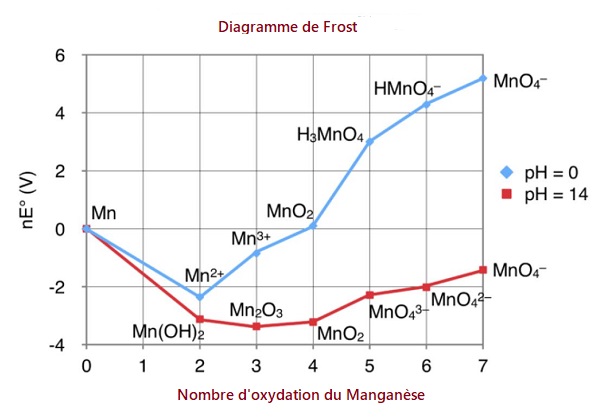
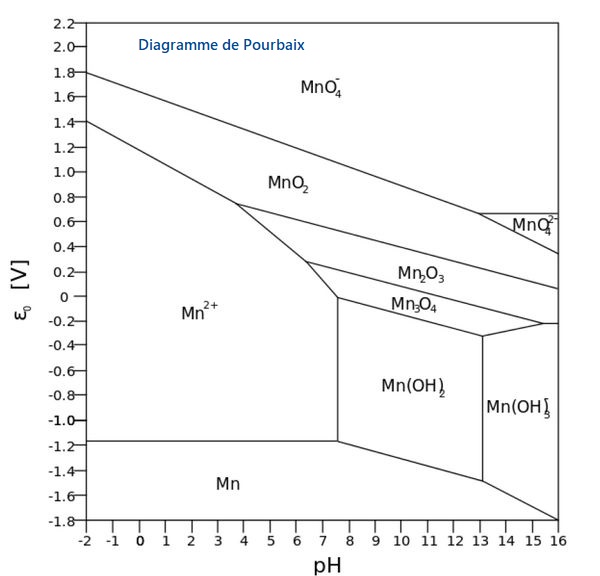
L'ion permanganate correspond à un état d'oxydation +7 du manganèse.
Principe de la manganimétrie
Le couple rédox mis en jeu est MnO4- / Mn2+ dont le potentiel standard vaut 1,507V. Les propriétés oxydantes de l'ion permanganate sont à l'origine de la manganimétrie. La forme oxydante MnO4- est violette, la forme réductrice Mn2+ est incolore, ce qui permet de déterminer le point équivalent sans utiliser d'indicateurs colorés.
En milieu acide la demi réaction du couple MnO4-/Mn2+ s'écrit:
MnO4- + 8 H+ + 5 e- ⇌ Mn2+ + 4H2O
Les ions H+ sont mis en excès. On utilise de l'acide sulfurique H2SO4. L'acide chlorhydrique et l'acide nitrique ne conviennent pas. Le 1er est oxydé par MnO4-, le second est également un oxydant.
L'excès d'acide sulfurique permet d'éviter la réaction en milieu neutre:
MnO4- + 2H+ ⇌ MnO2 + 4 OH-
Etalonnage des solutions de permanganate
Le permanganate se dégrade sous l'action de la lumière suivant la réaction :
4MnO4- + 2H2O ![]() 4 MnO2 + 3O2 + 4OH- .
4 MnO2 + 3O2 + 4OH- .
L'espèce MnO2 donne une couleur brune à la solution. Les solutions permanganate doivent donc être étalonnée.
On utilise généralement pour l'étalonnage une solution fraîchement préparée de sel de Mohr FeSO4,(NH4)2SO4,6H2O qui est une solution stable d'ion Fe2+.
