Intensité du courant en électrochimie
L'expression générale du courant
dépend de la vitesse de la réaction.
![]() On peut supposer que la réaction obéit à une loi avec un ordre de réaction. Consultez la page sur les ordres de réaction pour révoir le principe de ces lois de vitesse.
On peut aussi supposer que dans le cas d'un transfert monoélectronique que l'ordre de la réaction est égal aux coefficients stoechiométriques.
On peut supposer que la réaction obéit à une loi avec un ordre de réaction. Consultez la page sur les ordres de réaction pour révoir le principe de ces lois de vitesse.
On peut aussi supposer que dans le cas d'un transfert monoélectronique que l'ordre de la réaction est égal aux coefficients stoechiométriques.
Ainsi pour une réaction :
![]() Au voisinage de l'électrode (les concentrations sont celles à la surface de l'électrode au temps t) l'on a :
Au voisinage de l'électrode (les concentrations sont celles à la surface de l'électrode au temps t) l'on a :
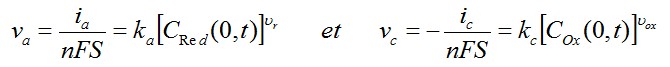
En général, les coefficient stoechiométriques sont égaux à 1 pour un transfert monoélectronique d'où :
ka et kc sont les constantes de vitesse des 2 processus : ka pour l'oxydation et kc pour la réduction. Leur unité est le cm.s-1.
Il est admis que les constantes de vitesses de transfert de charge ka et kc peuvent s'écrirent en fonction de la constante de vitesse standard k0
comme dans le cas de processus chimique avec la loi d'Arrhenius.
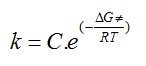 avec C une constante.
On admet que les constantes de vitesse s'écrivent sous la forme ci-dessous avec α, le coefficient de transfert de charge (compris entre 0 et 1 et généralement de valeur proche de 0,5).
avec C une constante.
On admet que les constantes de vitesse s'écrivent sous la forme ci-dessous avec α, le coefficient de transfert de charge (compris entre 0 et 1 et généralement de valeur proche de 0,5).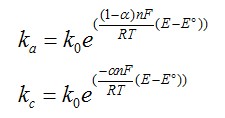 avec :
avec :
α : coefficient de transfert de charge
k0 : constante de vitesse standard
E° : le potentiel standard du couple
D'où l'expression du courant :
![]() L'intensité du courant comprend une composante anodique et une composante cathodique dont l'évolution est exponentielle. Le voltampérogramme obtenu étant la somme de ces 2 composantes.
L'intensité du courant comprend une composante anodique et une composante cathodique dont l'évolution est exponentielle. Le voltampérogramme obtenu étant la somme de ces 2 composantes.
