Equilibrer une réaction d'oxydoréduction
Méthode pour équilibrer les équations rédox
Il est souvent nécessaire d'écrire la demi-réaction d'un couple rédox Ox/Red avant de pouvoir établir l'équation bilan d'une réaction d'oxydoreduction. Quelques règles simples à appliquer permettent de les équilibrer facilement.
Sous sa forme générale, la demi-réaction s'écrit:
Important, les électrons se situent toujours du côté de l'oxydant.
Règle 1: conservation de la matière.
On doit retrouver de chaque côté de l'équilibre le même nombre d'atome.
Règle 2: électroneutralité.
On doit avoir le même nombre de charge (électrons et ions) de chaque côté.
Equilibrer un couple rédox pas à pas
Exemple: couple S4O62-/S2O32-
Application de la règle 1: Pour retrouver les 4 atomes de soufre, il faut multiplier par 2 l'espèce S2O32-.
D'où: S4O62- ⇌ 2 S2O32-
Application de la règle 2: on a 2 électrons du côté gauche et 4 du côté droit, il faut donc rajouter 2 électrons: S4O62- + 2 e- ⇌ 2 S2O32-
La réaction du couple rédox est équilibrée.
Exemple: couple MnO4-/Mn2+
Remarque: lorsque l'oxydant contient des atomes d'oxygène et que le réducteur n'en contient plus, il suffit généralement de rajouter des molécules d'eau.
MnO4- ⇌ Mn2+: les atomes de Mn sont équilibrés (1 de chaque côté)
MnO4- ⇌ Mn2+ + 4 H2O: on rajoute 4 molécules d'eau pour équilibrer le nombre d'oxygène.
MnO4- + 8H+ ⇌ Mn2+ + 4 H2O: on rajoute 8 protons H+ correspondants aux 4 molécules d'eau.
MnO4- + 8H+ + 5e- ⇌ Mn2+ + 4 H2O on rajoute 5 électrons pour l'électroneutralité.
La réaction du couple rédox est équilibrée.
Equilibrer une réaction d'oxydo réduction
Si l'on plonge une plaque de cuivre dans une solution de nitrate d'argent, l'on va observer l'apparition d'un dépôt sur la plaque de cuivre et une coloration bleuté de la solution.
Dans cette expérience, 2 couples redox sont mis en jeu.
Le potentiel du couple rédox du cuivre Cu2+/Cu est égal à 0,342 V et celui de l'argent Ag+/Ag vaut 0,7996V. La réaction est donc possible entre le cuivre Cu et l'argent en solution Ag+ (voir règle du gamma).
Coules rédox mis en jeu
: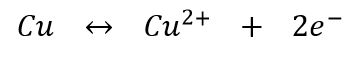
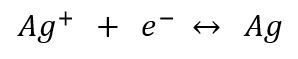 Les règles à appliquer sont identiques à celle des demi-équation rédox. Il faut donc multiplier par 2 la demi-réaction de l'argent pour avoir 2 électrons et atteindre l'électroneutralité de la solution.
Les règles à appliquer sont identiques à celle des demi-équation rédox. Il faut donc multiplier par 2 la demi-réaction de l'argent pour avoir 2 électrons et atteindre l'électroneutralité de la solution.
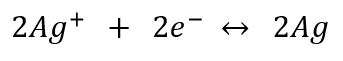 L'équation bilan s'écrit donc :
L'équation bilan s'écrit donc :
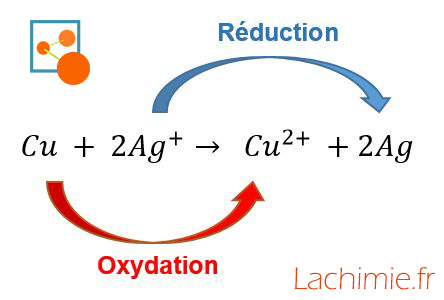 Il important de vérifier la conservation de la matière et le respect de l'électroneutralité : on retrouve bien de chaque côté de la réaction : 2 atomes d'argent, 1 atome de cuivre et 2 charges +.
Il important de vérifier la conservation de la matière et le respect de l'électroneutralité : on retrouve bien de chaque côté de la réaction : 2 atomes d'argent, 1 atome de cuivre et 2 charges +.
La réaction en image : 


