Surtension ou polarisation
Les cellules électrochimiques sont soumises à un autre phénomène appelé surtension et noté η.
Comme cela a été vu sur la fiche concernant la chute ohmique, la tension U' est proportionnelle à l'intensité. Si l'on trace l'intensité en fonction de la tension, on s'attend donc à avoir une droite de pente R.
Ceci est valable pour les faibles tensions, mais dès que celle-ci augmente, la cellule se polarise et l'on obtient plus une droite (courbe bleue). Il faut donc appliquer une tension supérieure à la théorie. La différence s'appelle la surtension.
La relation de la tension s'écrit donc :
U' = U + RI + η
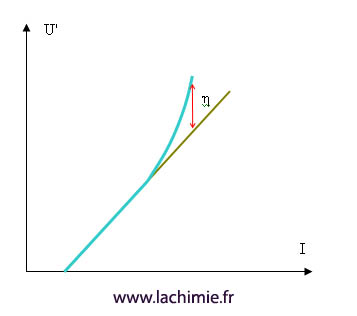
La polarisation peut fortement varier d'une électrode à l'autre selon la nature de l'électrolyte, de l'électrode, de l'intensité...
Phénomène de polarisation
Au niveau de l'électrode les réactifs se déplacent selon 3 mécanismes:
- la diffusion
- La convection
- La migration
La diffusion est due au gradient de concentration lorsque l'on se rapproche de l'électrode. La consommation ou production d'espèces au niveau de l'électrode modifie localement (couche de quelques nanomètres) leur concentration. Dans le cas d'un dépôt de cuivre, l'espèce Cu2+ s'appauvrit lorsque l'on se rapproche de l'électrode. Il y a donc diffusion depuis le cœur de la solution vers l'électrode.
La convectionest le déplacement des espèces en solution par un moyen mécanique comme l'agitation par exemple.
La migration est le phénomène de déplacement des espèces chimiques sous l'action d'un champ électrique.
Ces 3 phénomènes sont à l'origine de la polarisation: s'ils ne parviennent pas à transporter suffisamment de réactifs, la tension à appliquer devient supérieure à la valeur théorique et on atteint une valeur de courant limite. Ce dernier est généralement proportionnel à la concentration en réactif.
A noter qu'il existe également une polarisation cinétique dû au transfert électronique entre les réactifs et les électrodes.
