Cinétique électrochimique, expression du courant
Par définition, la vitesse d'une réaction est définie comme étant la dérivée par rapport au temps de l’avancement. Ces relations sont essentielles pour la compréhension des courbes intensité-potentiel et des phénomènes électrochimiques aux électrodes.
Prenons le cas général d'une demi-réaction d'oxydo-réduction:
![]()
L'avancement de la réaction va s'écrire :
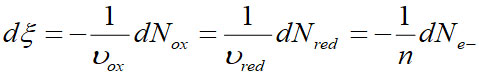
D'où l'expression de la vitesse :
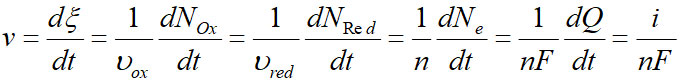
En tenant compte de la surface S de l'électrode, on passe à la vitesse surfacique :
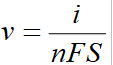
La relation devient avec v la vitesse surfacique et j la densité de courant:
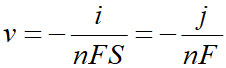
Selon que la réaction est anodique ( i positif) ou cathodique ( i négatif), on aura :
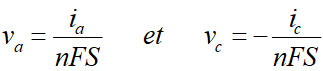
D'où l'expression générale du courant :
![]()
L'intensité du courant sera donc proportionnelle à la surface de l'électrode et à la vitesse de la réaction.
La vitesse de réaction globale d'une réaction électrochimique est égale à la différence entre la vitesse de réaction anodique et cathodique. v = va – vc
Si on déplace l'équilibre vers la réaction cathodique en imposant un courant inférieur au potentiel d'équilibre, la vitesse cathodique devient supérieure à la vitesse anodique. Le courant aura donc un signe négatif.
