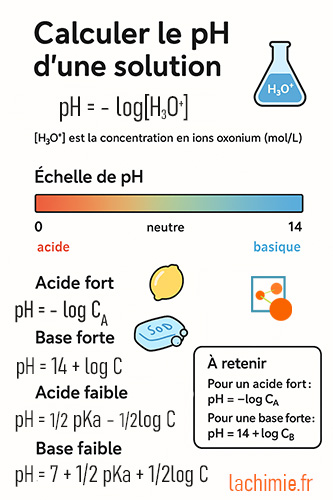
Formule de calcul de pH
Calcul du pH en fonction de la concentration C de l'acide ou de la base et de leur pKa dans le cas d'acides et de bases faibles. Ces formules ont été établies en effectuant les approximations usuelles (solutions suffisament concentrées pour ne pas tenir compte de l'autoprotolyse de l'eau, concentrations à la place des activités...) .
pH des solutions d'acides forts
Les acides forts ( HCl, H2SO4, etc...) sont totalement dissociés dans l'eau.
Tableau d'avancement pour un acide fort AH de concentration CA :
| AH | + | H2O | → | A- | + | H3O+ | |
| A t = 0 | CA | Excès | 0 | 0 | |||
| A t final | 0 | Excès | CA | CA |
pH = - log [H3O+] = - log CA
pH des solutions de bases fortes
Les bases fortes (NaOH, KOH, NH3, etc...) sont totalement dissociées dans l'eau.Tableau d'avancement pour une base forte BH de concentration CB :
| BH | + | H2O | → | BH+ | + | OH- | |
| A t = 0 | CB | Excès | 0 | 0 | |||
| A t final | 0 | Excès | CB | CB |
pH = 14 + log C
Ces formules sont valables pour les concentrations supérieures à 10-7 mol/L
pH d'acides et de bases faibles
Pour un acide faible :
pH = 1/2
pKa - 1/2log C
Pour une base faible :
pH = 7 + 1/2
pKa + 1/2log C
Ces formules sont valables pour les concentrations comprises entre 1mol/L et 10-6 mol/L
pH d'une solution de sels d'acides et bases faibles
Pour les solutions de sels d'aide faible et base faible, le pH est donné par la relation (exemple d'une solution préparée à partir de CH3COONH4):
pH = 1/2( pKa1 + pKa2)
Infographie à télécharger des formules de pH
 Electrode de verre
Electrode de verre
