Dosage de l'acide acétique avec un pH-mètre
Le but de cette manipulation est de déterminer la concentration molaire d'une solution diluée d'acide acétique CH3COOH. On utilise la soude NaOH comme titrant.
C'est un dosage acide faible - base forte. La réaction est totale et s'écrit :
CH3COOH + NaOH → CH3COO- + Na+ + H2O
Principe du titrage
Un volume VA de 10 mL d'acide acétique de concentration inconnue CA est prélevé à l'aide d'une pipette jaugée munie d'une propipette et versé dans un bécher de 100 mL.
Le suivi est effectué par pH-métrie.
Il est possible d'ajouter de l'eau distillée si l'électrode combinée n'est pas entierement immergée.
L'agitation est mise en route.
La solution de soude de concentration CB=0,1 mol/L placée dans la burette est ajoutée mL par mL. Le pH est relevé après stabilisation.
Attention, l'électrode combinée de pH doit être préalablement étalonnée à l'aide de solutions tampons de pH=7 et pH=10.
| V en mL | pH |
|---|---|
| 0 | 3,13 |
| 1 | 3,7 |
| 2 | 4,09 |
| 3 | 4,37 |
| 4 | 4,58 |
| 5 | 4,79 |
| 6 | 5 |
| 7 | 5,24 |
| 8 | 5,58 |
| 9 | 6,4 |
| 10 | 11,23 |
| 11 | 11,82 |
| 12 | 11,98 |
| 13 | 12,12 |
| 14 | 12,2 |
| 15 | 12,27 |
| 16 | 12,33 |
| 17 | 12,37 |
| 18 | 12,42 |
| 19 | 12,45 |
| 20 | 12,48 |
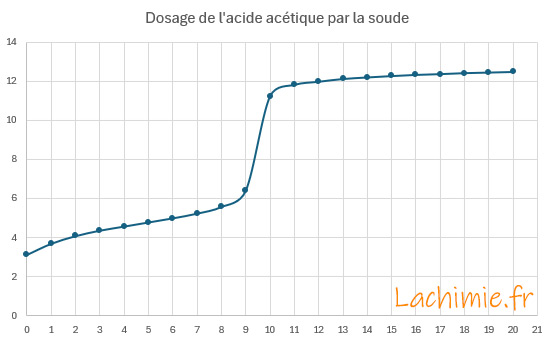
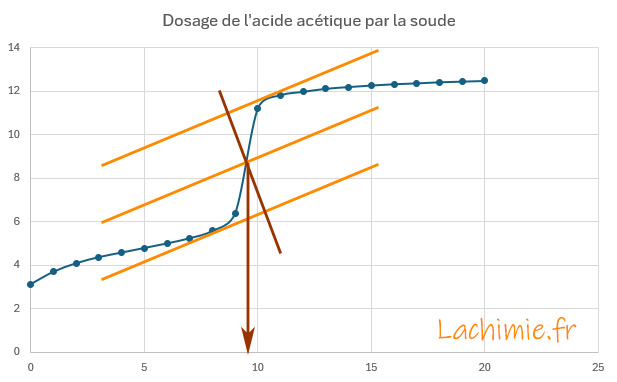
Le tracé du pH en fonction du volume de soude versé permet de déterminer le point équivalent au niveau du saut de pH.
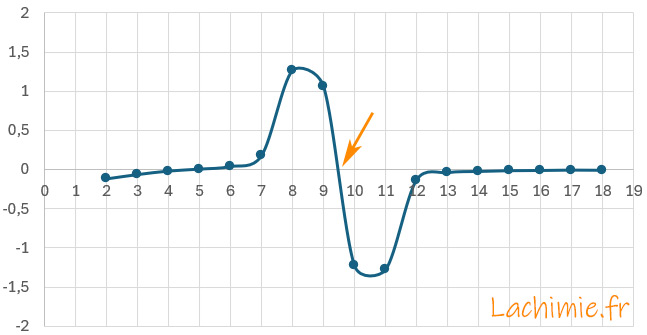
 Le tracé de la dérivée seconde permet une détermination plus précise
Le tracé de la dérivée seconde permet une détermination plus précise
Calcul de la concentration
A l'équivalence, le volume versé de soude VB = 9,5 mL
D'après la relation de la réaction, on a CAVA = CBVB
d'où CA = CBVB/VA
Application numérique: CA=0,1x9,5/10 = 0,095 mol/L
Bon à savoir : le nom officiel de l'acide acétique est l'acide éthanoïque
Le pH à l'équivalence est supérieur à 7 puisqu'il ne reste dans la solution que l'éthanoate de sodium, la base conjuguée de l'acide.
