La stéréoisomérie : énantiomères, chiralité, conformation
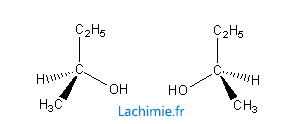
On appelle des stéréoisomères des isomères de constitution ayant la même formule semi-developpée mais qui diffèrent par la disposition spatiale de leurs atomes ou groupements d'atomes. Les molécules ne sont pas superposables. Ci-dessous, l'exemple du butan-1-ol.
On distingue plusieurs types:
- les isomères de configuration : elles sont isolables et le passage de l'un à l'autre nécessite la rupture d'une ou plusieurs liaisons. Leurs propriétés physico-chimques sont également différentes.
- les isomères de conformation : elles ne sont pas isolables et s'obtiennent par rotation autour d'une liaison simple.
Les isomères de configuration
A nouveau, il existe 2 types d'isomérie de configuration :
- L'isomérie géométrique
- L'isomérie optique
Isomérie géométrique
On la rencontre notamment avec les alcènes et dans les molécules cycliques.
Les alcènes, du fait de la rigidité de la double liaison (pas de rotation possible) peut prendre 2 configurations différentes notées Z et E selon la disposition des groupements prioritaires.
Pour déterminer la configuration Z ou E d'un alcène, il faut appliquer la règle des séquences de Cahn, Ingold, Prelog. Il faut également se rappeler que les lettres Z et E proviennenet de l'allemand et signifient :
- Z pour Zusammen = ensemble
- E our Entgegen = opposé.
La méthode consiste donc dans un premier temps à classer les groupements des carbones de la double liaison et dans un second temps de regarder leur position par rapport à l'axe de la double liaison.
S'ils sont du même côté, la configuration sera Z. Par contre s'ils sont opposés elle sera E.
Configuration cis et trans
Le noms "cis" et "trans" proviennent de latin et signifient respectivement "ensemble et "à travers". Mais ici on classe les groupements prioritaires selon leur encombrement stérique (du plus gros au plus petit).
Le plus souvent une molécule Z sera "cis et E sera "trans" mais la règle n'est pas toujours valable. L'encombrement stérique n'étant pas toujours une donnée facile à déterminer, la configuration Z et E est à privilégier pour les alcènes.
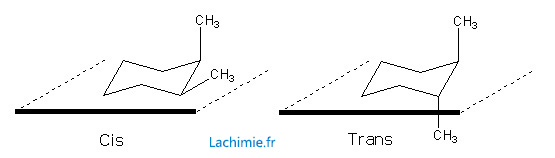
Isomérie des cycles saturés :
Comme pour les alcènes, on peut sur certains cycles saturés avoir des configurations différentes selon la position des groupements. Cela est possible sur les cycles où l'on peut définir un plan moyen. Si les groupements prioritaires sont situés du même côté, la molécule sera « cis », sinon elle sera « trans ».
Isomérie optique ou énantiomérie
Les énantiomères (ou isomères optiques) sont des molécules ayant plusieurs caractéristiques spécifiques :
- Elles ont la propriété de dévier le plan de polarisation de la lumière. C’est ce que l’on appelle avoir un pouvoir rotatoire. Ces isomères font varier la lumière polarisée soit vers la droite soit vers la gauche et seront notées respectivement dextrogyres et lévogyres.
- Elles sont l’image l’une de l’autre dans un miroir et donc non superposables.
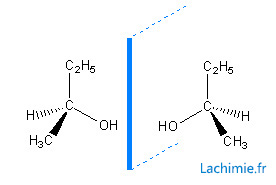
Configuration absolue R et S
Pour différencier les 2 énantiomères, par exemple les 2 molécules de butan-1-ol, on utilise les configuration R pour Rectus et S pour Sinister. Le lettres R correspond au sens de rotation des aiguilles d'une montre et la lettre S au sens inverse.
Pour déterminer la configuration R,S on utilise la représentation de Newman en prenant comme axe le carbone asymétrique et le groupement de plus faible priorité. Ici encore, la priorité des groupements est déterminée par la règle des séquences de Cahn, Ingold, Prelog.
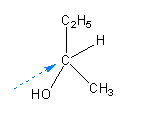
On tourne ensuite du groupement priotaire vers les plus faibles.
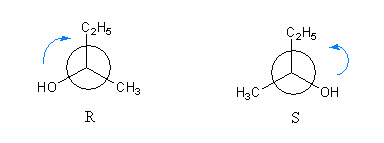
Diastéréosimères
Lorsqu'une molécule a plusieurs carbones asymètriques, le nombre de d'isomères possible est égal à 2n avec n le nombre de carbones asymétriques.
Lorsque les isomères sont l'image l'une de l'autre, comme indiqué précédemment, ce sont des énantiomères. Si ce n'est pas le cas, ce sont des diastéréosimères.
Chiralité
La chiralité est la relation d’un objet et son absence de symétrie. Les énantiomères sont des molécules chirales. Donc, elles n'ont pas de plan ou d'axe de symétrie.
Enfin, la chiralité est souvent due à la présence d’un carbone asymétrique, c’est-à-dire un carbone sp3 ayant 4 atomes ou groupements d’atomes différents.
Les isomères de conformation
La rotation autour d'une liaison simple C-C permet d'avoir une infinité de conformations. Toutefois certaines positions sont particulières avec des niveaux d'énergie potentielle plus ou moins élevés. Les liaisons hydrogènes intramoléculaires peuvent également stabiliser une conformation particulière.
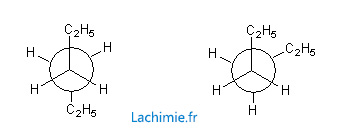
Exemple de la molécule d'hexane :
La conformation de gauche est plus stable car l'encombrement stérique est optimisée. A droite, les 2 groupement éthyles sont plus proches d'où une énergie potentielle plus élevée.