Concentration et activité d'une solution
Lorsqu'une espèce chimique (ion ou molécule) est en solution, des interactions soluté-solvant et soluté-soluté ont lieu. La disponibilité de l'espèce chimique vis-à-vis d'une réaction peut alors apparaître très différente de la concentration dans la solution. Ceci est d'autant plus vrai que la concentration dans la solution est élevée. Pour traduire cet écart au cas idéal où le soluté ne subit aucune interaction, on introduit la notion d'activité d'une solution qui correspond à la concentration active de la solution.
L'activité pour l'espèce chimie "i" est notée "ai" et s'écrit :
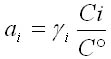 avec :
avec :
ai : l'activité
γi : le coefficient d'activité. Il est compris entre 0 et 1. Il est égal à 1 pour les solutions idéales.
Ci : la concentration
C° : concentration de référence égale à 1 mol/L
L'activité est sans dimension. Pour les solutions diluées (inférieure à 10-3 mol/l), l'activité est proche de la concentration. Pour les corps purs et le solvant, l'activité est égale à 1.
Modèle de Debye-Hückel
Ce modèle permet de calculer le coefficient d'activité d'un ion en solution. On considère que les interactions sont uniquement d'ordre électrostatiques entre les ions.
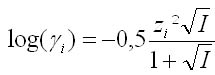
Avec :
- I la force ionique de la solution en mol/l
- z la charge de l'ion
![]()
Nombre de transport : le nombre de transport d'un ion est la fraction du courant total transporté par cet ion. Il est noté t.
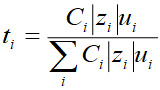
avec u la mobilité de l'ion
